Bigger and Better Photons: The Road to Great FLIM Results
原文链接
翻译 by 谭瓅
摘要:这篇文章试图帮助bh FLIM技术的现有和未来用户从FLIM实验中获得最佳结果。第一部分解释了TCSPC FLIM的原理,并给出了记录的光子分布的效果。它表明,测量寿命的信噪比在优先取决于记录的光子数量。第二部分重点介绍优化光子数,而不增加施加到样品中的光应力。我们讨论了激发功率、采集时间、采集效率、数值孔径、聚焦精度、对准精度和探测器效率的影响。第三部分将重点介绍光子效率。它考虑了TCSPC计时参数、计数背景、像素数、仪器响应函数的影响,以及多指数衰减函数的挑战。最后一部分专门介绍数据分析。本文中的所有结论均通过在实际条件下记录的真实测量数据进行演示。
第四部分:数据分析
数据分析无法弥补低质量的FLIM数据,但可以从样本和实验优化设计后采集的数据里提取大量信息,详情参考文献[3]。以下部分仅介绍几个要点,并在典型的 FLIM 数据上进行了演示。
选择什么模型拟合?
关于FLIM数据分析的第一个问题通常是:我应该使用哪种模型?需要多少个衰减分量才能拟合结果?
答案并不取决于样品实际具有的衰减分量的数量,而是取决于你希望从样品中找出什么信息。因此,除了你自己,没有人能回答这个问题。你对特定生物系统中正在发生的事情有一个假设,你设计了一个实验和一个样本来确认或排除假设。只有你才能知道样品中预期会发生什么,只有你才能知道衰减函数中预计会有多少分量。因此,你应该选择不同的,并具有相应衰减分量数的模型(并且只有这个模型)来拟合数据。
比如,你正在做一个蛋白质相互作用实验,采用FRET作为蛋白质相互作用的指示,用供体标记一种蛋白质,用受体标记另一种蛋白质。在蛋白质相互作用的地方应该发生FRET,FRET缩短了供体的荧光寿命。因此,您可以在供体发射波长处获取FLIM数据。在 SPCImage 中加载数据并使用单指数模型运行分析。细胞膜中的荧光寿命最短处 – 正是您预计的蛋白质相互作用的地方(图30,左)。
您可以检查图像的几个特征点中的衰减函数。在寿命较短的地方,单指数模型不能正确拟合衰减函数,但双指数模型适合(图 30,左二)。这是合理的:首先,并非所有供体分子都对受体具有正确的取向(FRET发生条件之一)。其次,蛋白质相互作用是一种化学平衡,应该有相互作用和非相互作用的供体的混合。这些组分具有不同的寿命,因此衰减曲线应该是双指数的。
现在,您可以使用双指数模型运行数据分析。对于显示,请选择振幅加权平均寿命 tm,这是经典 FRET 效率的表示,如图 30 右二所示。接下来,选择快衰减分量和慢衰减分量的振幅之比,该比值表示相互作用和非相互作用的供体的相对数量,它在细胞膜中蛋白质相互作用的地方最高,见图30,右图。结果表明,双指数模型适合拟合数据,并且表明初始假设可能是正确的。
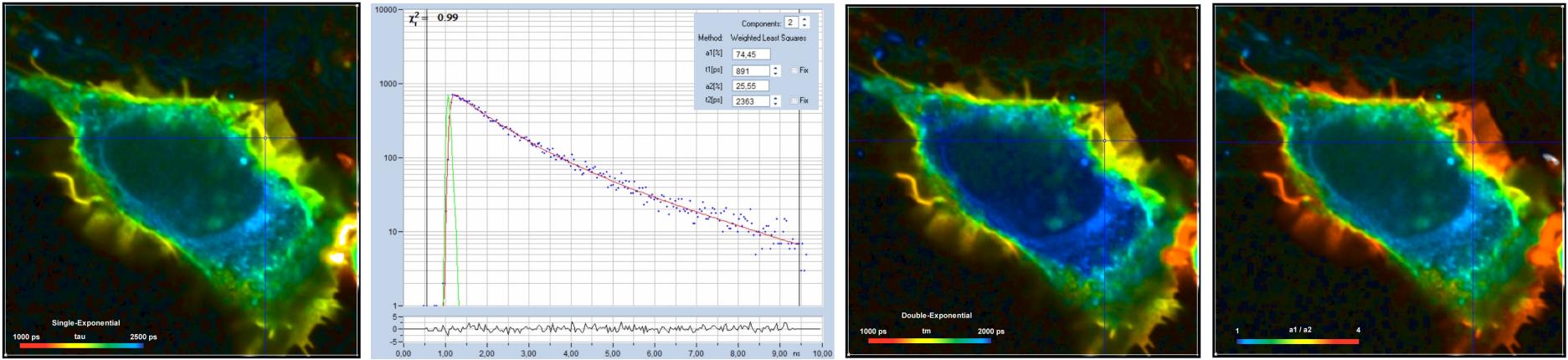
图 30:FLIM-FRET 测量结果。从左到右:单指数寿命图像,光标位置衰减曲线,双指数模型的振幅加权寿命图像(显示经典FRET强度),振幅比图像,显示相互作用蛋白质的相对比值)。
选择要显示的参数
SPCImage提供了几个选项来显示衰减函数的参数:经典的单指数寿命,衰减分量的寿命,振幅加权平均值和强度加权平均的分量寿命值,以及衰减分量中包含的相对强度,参考文献[3],SPCImage 还显示这些参数的比值。如果可能,应选择最清楚地显示感兴趣效果的参数组合。例如,在 FRET测量中,双指数拟合的振幅加权寿命表示经典的 FRET效率,以及振幅之比 a1/a2(相互作用供体的相对比值)。示例如上图 30 所示。
代谢成像的示例如图31所示。左图显示了自由和束缚NADH的衰减分量的振幅比,该参数表征细胞的代谢状态。分量寿命(t1 和 t2)的图像显示在中间和右侧,寿命的不均匀性表明NADH处在单个线粒体中的不同的分子环境。
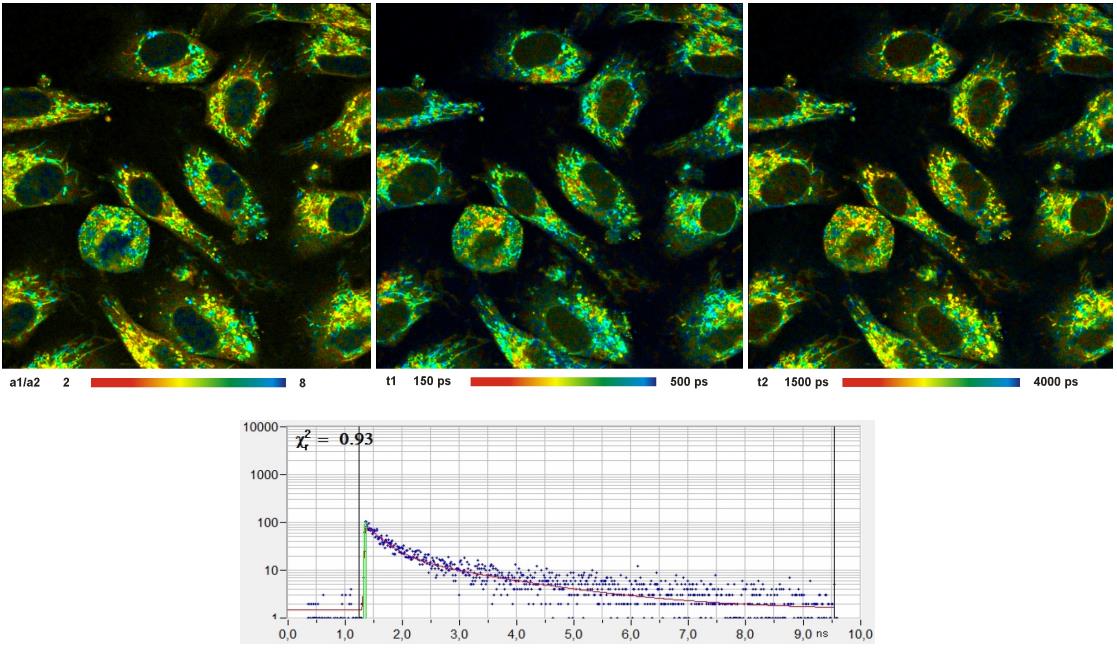
图31:从左到右:活细胞的NADH图像。振幅比,a1/a2(未束缚/束缚比)以及快衰减分量(t1,未束缚的NADH)和慢衰减分量(t2,束缚的NADH)的图像。FLIM数据格式 512×512像素。底部:选定点的衰减曲线,1024个时间通道,时间通道宽度 10ps。
Binning——“像素合并”
FLIM用户通常不赞成将寿命数据合并,认为这是一种不科学地调整测量结果的方式。然而,正确的合并是任何准确可靠的FLIM数据分析的关键。光学系统成像时,空间分辨率受到衍射极限的限制,单点光的衍射图称为Airy圆盘或(在显微镜下)点扩散函数。为了达到衍射极限分辨率,数据不得通过像素化来模糊。根据经验,点扩散函数的中心圆盘应约按 5 x 5像素采样,当然,此区域内像素中的寿命信息非常相似。因此,将这些像素的时间数据组合用于FLIM分析是合适的,请参见图32左。结果是光子数大幅增加,寿命精度相应提高。请注意,合并5 x 5像素区域会使净光子数增加25倍!
在 SPCImage 软件中,通过组合定义合并区域的数据并将净衰减曲线分配给中心像素来执行合并。因此,图像中的有效像素数不会改变,该程序还符合优质图像的美学角度。从视觉上看,图像在开始看起来很丑陋之前,包含大量的强度噪声。然而,在FLIM应用中,寿命数据中相同数量的噪声将使数据无用。因此,在具有一定强度噪声的大量像素下显示图像是有意义的,但寿命平均在更大的区域内,并且相应地增加了信噪比。
SPCImage 中的像素合并原理如图 32 右所示。
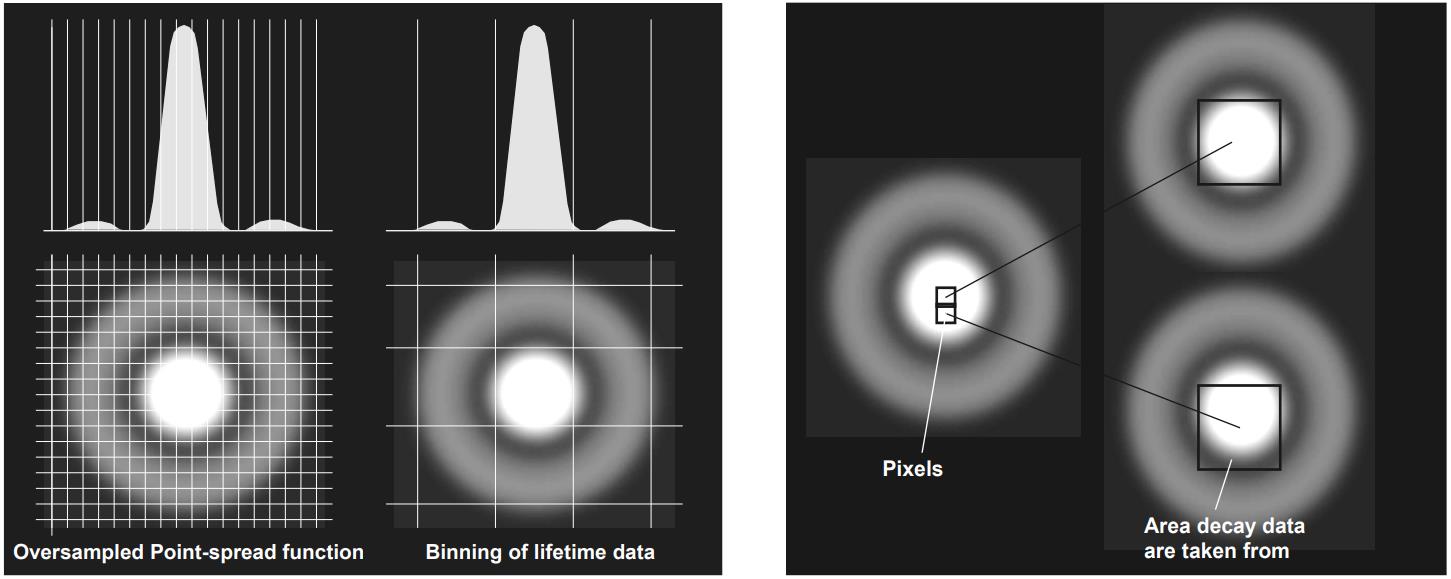
图 32:左:对强度图像中的 Airy 圆盘进行过采样,以及合并像素用于寿命计算。右:用于寿命计算的像素重叠合并。
SPCImage 软件中合并参数(binning parameter) n 的含义如图 33 所示。请注意,合并系数2对应 5 x 5 像素区域,即大致对应于正确采样图像中点扩散函数的面积。无意中,图像通常使用较高的过采样率拍摄,尤其是在使用扫描仪的高变焦系数时。因此,SPCImage提供合并系数最多为10像素合并,对应 20 x 20 的像素区域。
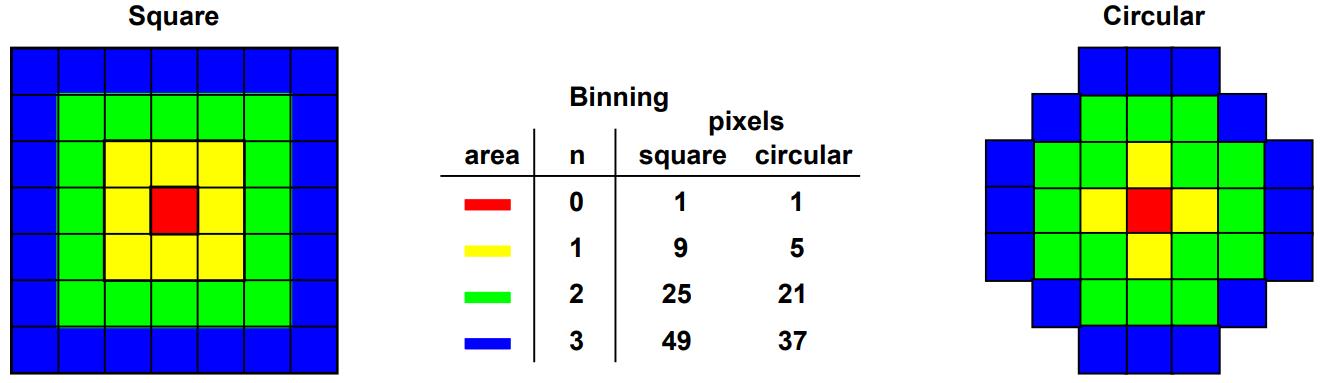
图 33:合并系数n的功能,‘Square’(左)和‘Circular’ (右)合并。
图 34 给出了像素合并(binning)效果的演示,用512 x 512像素扫描BPEA样品,将衰减曲线记录到1024个时间通道中。未做像素合并的数据如图 34 的顶行所示。左侧显示了(单指数)寿命图像。在不进行像素合并的情况下,每个像素的光子数量极低,请参阅中图。因此,寿命图像看起来很嘈杂,衰减时间散布在各处,请参阅右侧的寿命直方图。图 34 的底行显示了使用像素合并的数据。采用圆形合并,合并系数为 2,对应21 个像素区域的合并。寿命图像质量优异,净衰减函数具有足够的光子以进行合理拟合,并且寿命直方图具有合理的宽度。从图像中可以看出,颜色不会模糊,即像素合并不会对整个寿命的空间分辨率造成明显的损失。
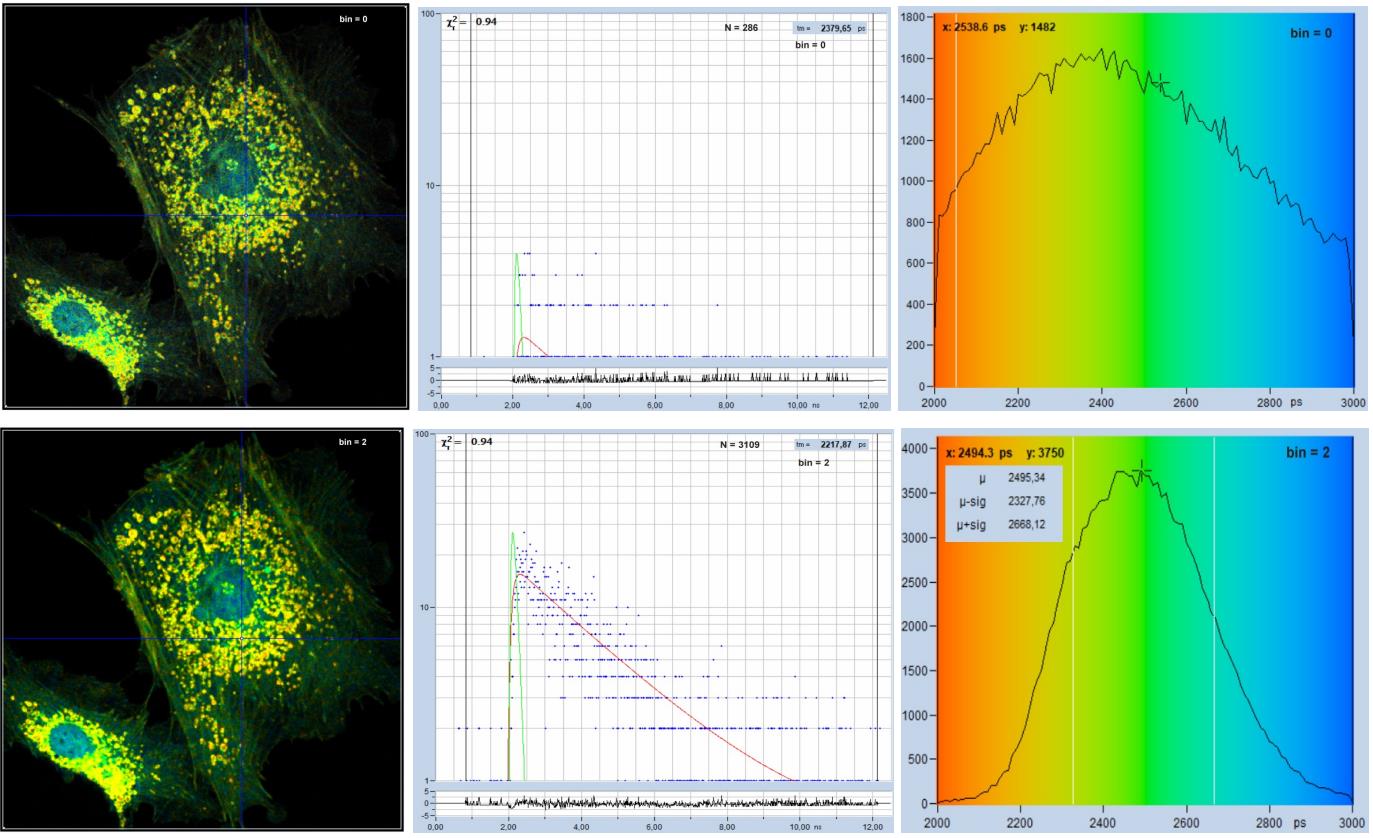
图 34:像素合并(binning)在寿命分析中的影响。512 x 512 像素,1024 个时间通道。顶部:无合并。底部:合并系数 2,圆形合并,21个像素的衰减曲线的总和用于中心像素的分析。
合并系数为2(将21个像素的衰减曲线合并到中心像素中,见图33),合并后的数据甚至足以进行双指数衰减分析。结果如图 35 所示,顶行从左到右显示了快衰减分量和慢衰减分量的寿命图像,以及两个分量振幅之比的图像。这三幅图像在空间分辨率和寿命分辨率方面都具有良好的质量。底行显示参数直方图,它们表明,分量寿命和振幅比是在良好的信噪比下获得的(请注意不同的参数范围)。
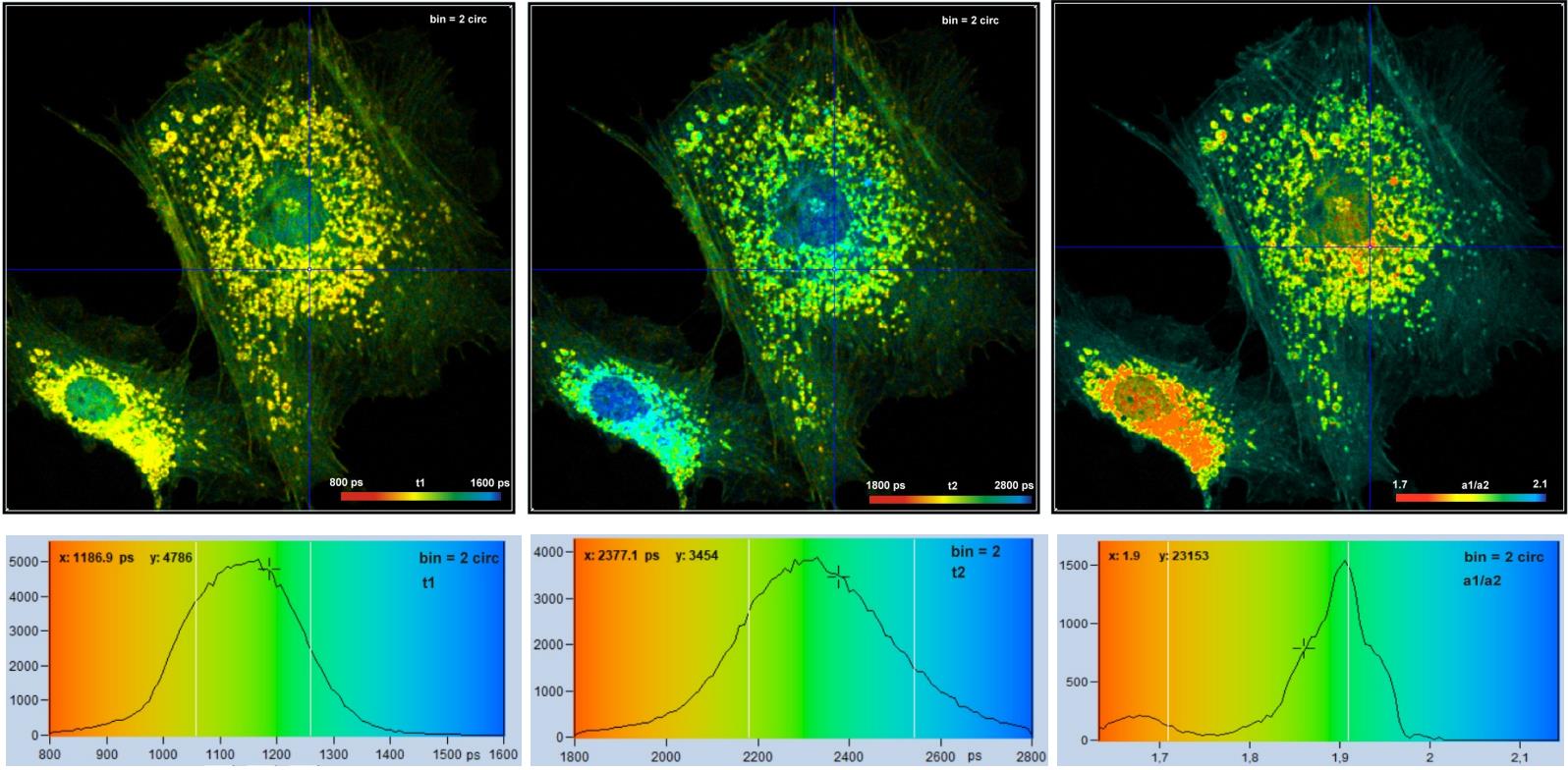
图 35:与图 34 中底行数据相同,双指数衰减分析。从左到右:快分量的寿命图像t1,慢分量的寿命图像t2,振幅比图像a1/a2。请注意不同的参数范围。
图36显示了合并对寿命信息的空间分辨率的影响。该图显示了图34和图35中大细胞中心70 x 70像素区域的数据。正如预期的那样,在合并系数≤2时,寿命对比度基本保持不变,请参考中心的花状结构。对于 4 和 6(右2和右1)的合并系数,寿命对比度开始降低。来自相邻像素的太多衰减数据被混合到净衰减函数中,因此,中间的结构越来越多地采用其更周围紧邻环境的寿命值。
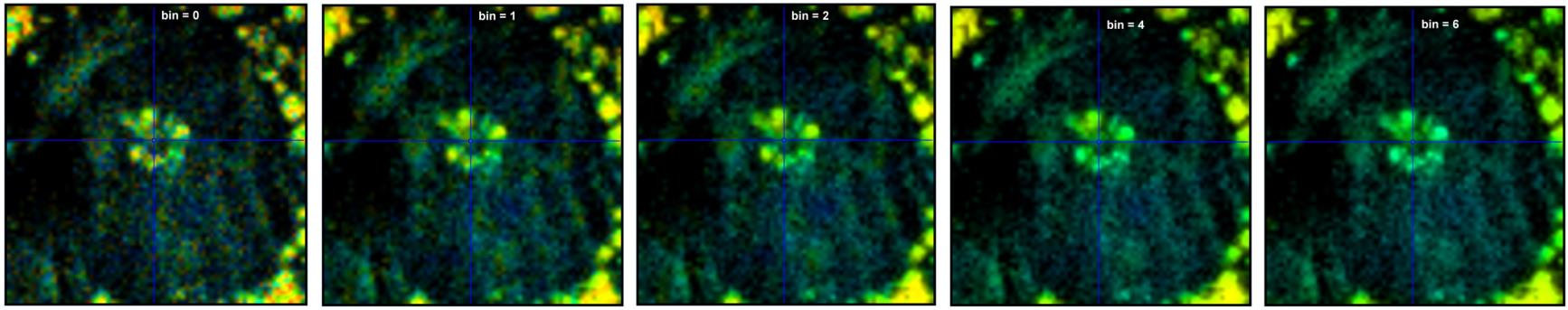
图36:放大图34数据的70 x 70像素区域,显示大细胞的中心。不同的合并系数,从左到右的n= 0、1、2、4 和 6。在 bin ≤2(中心图像),使用寿命对比度保持不变。它在 bin = 4 和bin = 6 时寿命对比度会降低,这可以从中心结构颜色的褪色中看出。
图像分割
与合并空间相关像素合并(binning)相比,图像分割是组合了具有类似衰减特征的像素。
该过程如图37左上所示,图37显示了SPCImage面板,其中包含低光子数的FLIM数据,数据与图 34 上行中的数据相同,所选像素中的衰减数据显示在面板的右下角。根据这些数据计算出的寿命图像是嘈杂的,并且寿命的直方图(右上)非常宽。下一步如图 37(右上方)所示。相量图(phasor plot)是根据数据计算得出的,不出所料,相量分散在各处。
然而,寿命明显不同的像素的相量(由颜色表示)出现在不同的相位/振幅位置。
在第三步中,选种一系列相量值,并在寿命图像中突出显示相应的像素,请参见图 37 左下角。可以移动选择区域,更改其大小和形状以突出显示图像中的所需结构。在所示的示例中,已选择细胞的线粒体。即使选择可能不完整,所选像素也都在图像的所需结构内。
在最后一步,图37,右下角,所选像素的衰减数据被组合成一条衰减曲线,这条曲线包含超过300万个光子。相比之下,图34中单个像素中只有几百个光子,在n=2的合并区域中大约有3000个光子。具有300万光子的衰减曲线可以进行高精度分析,三指数分析很轻松,如图 37 右下角所示,三指数衰减参数显示在面板的右上方。
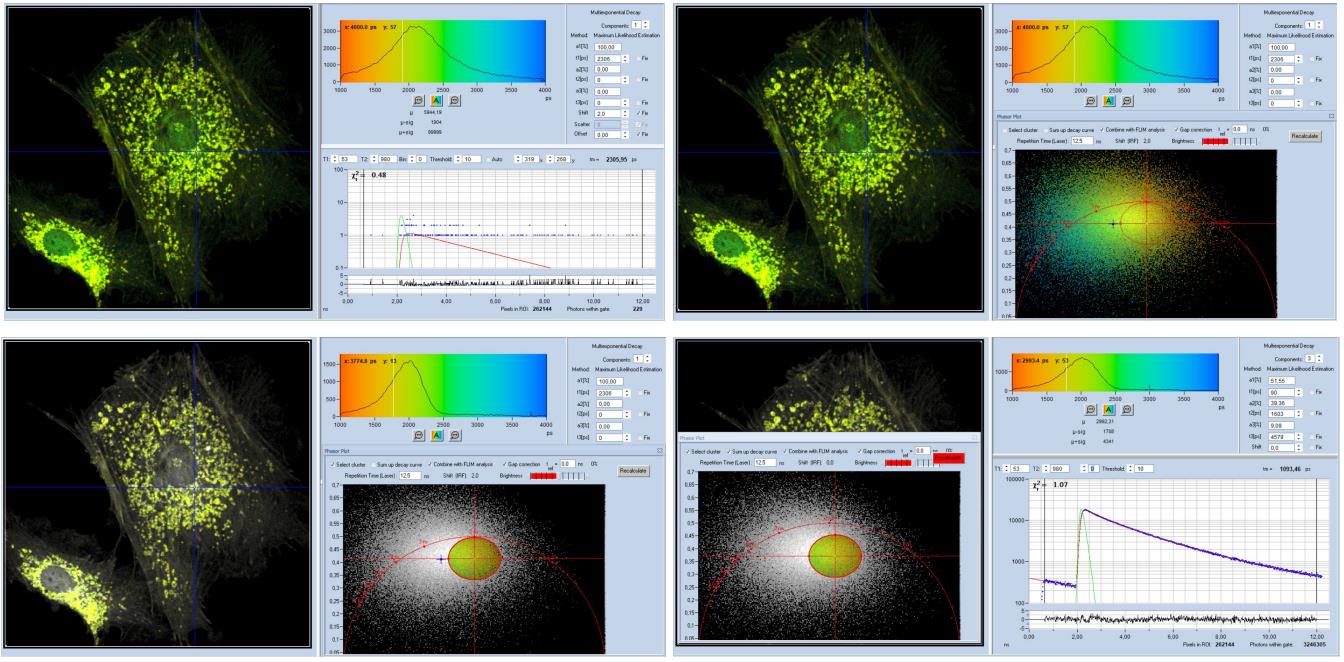
图37:通过相量图进行图像分割,并将所选像素组合成高光子数的单衰减曲线。
固定分量的寿命进行分析
如果减少衰减参数的数量,多指数衰减分析将变得更加容易。因此,在数据分析中包括先验知识可以减少结果中的噪声。图38显示了小鼠开放性肿瘤的NADH图像,用bh DCS-120 MACRO系统成像,有趣的参数是快速衰减分量的振幅a1。它代表游离NADH的比例,并指示组织相应区域的新陈代谢类型。因此,使用双指数模型对数据进行分析,并创建了a1图像。使用所有参数(t1,t2,a1,a2)自由浮动来分析左侧的图像,固定t2分析右侧的图像。不出所料,右侧的图像噪点较小,肿瘤在图像和a1直方图中都更清晰地突出。右侧的直方图甚至显示两个不同的像素群,一个为 a1 = 0.65,另一个为 a1 = 0.83,这些正是通常在健康组织和肿瘤组织中发现的振幅。
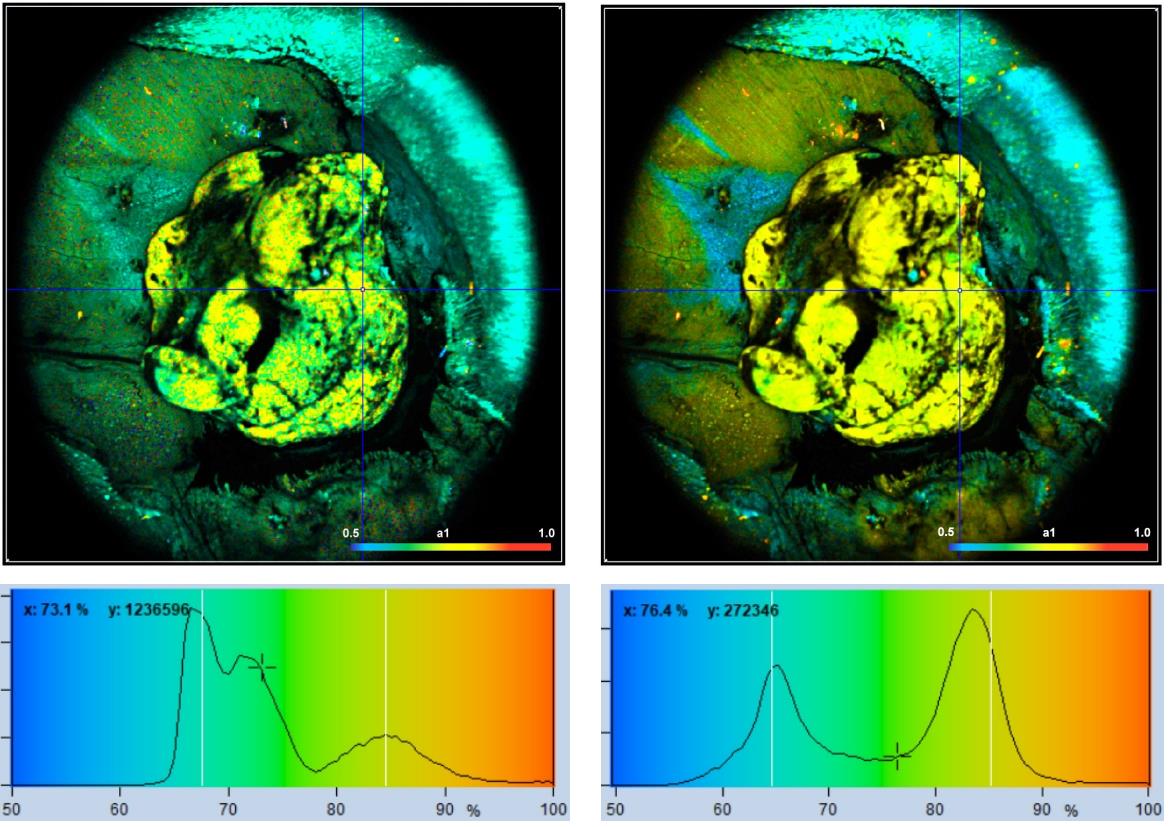
图38:小鼠肿瘤的NADH图像显示快速NADH成分的振幅a1。左:T1、t2、a1、a2浮动。右:t2 固定为最常用值,2400 ps。下行:图像像素上 a1 的直方图。
在衰减分量的寿命预计恒定的情况下,使用固定参数进行分析可以大大降低噪声。但是,必须谨慎使用该技术,荧光寿命从来都不是绝对恒定的,分子环境总是有影响的。如果分量寿命是固定的,但不是绝对恒定的,则拟合过程会以其他参数的较大变化来响应。因此,在固定分量寿命条件下,获得的拟合结果可能具有较大的系统误差。
最后一步:图像强度和参数范围
FLIM图像应清晰明了地展示相关论文中声称的科学事实,图像不仅应显示正确的衰减参数,还应将其显示在适当的强度和衰减参数范围内。默认情况下,SPCImage 使用强度自动缩放,在正常情况下,自动缩放会产生合理的图像。但是,自动缩放功能无法知道图像的哪个部分是包含感兴趣信息的部分。如果信息位于图像的暗淡区域,则自动缩放不一定能提供最佳图像。此外,其他完美的图像也可能包含一些过于明亮的点。在这些情况下,无论它们来自何处,自动缩放都不会生成合理缩放的图像,因此,应关闭自动缩放,并手动调整强度刻度。图39 显示了一个示例,自动缩放(左)会导致不良的缩放强度范围,手动调整强度范围可生成正确平衡的图像(右图)。
具有不同参数比例的图像的显示如图40和图41所示,这些图像显示了分别以蓝-绿-红和红-绿-蓝两色方向显示的寿命图像。参数范围为 2000 到 3000 ps(左)和 2300 到 2700 ps(右)。哪种风格最能体现感兴趣的效果,必须根据具体情况来决定。
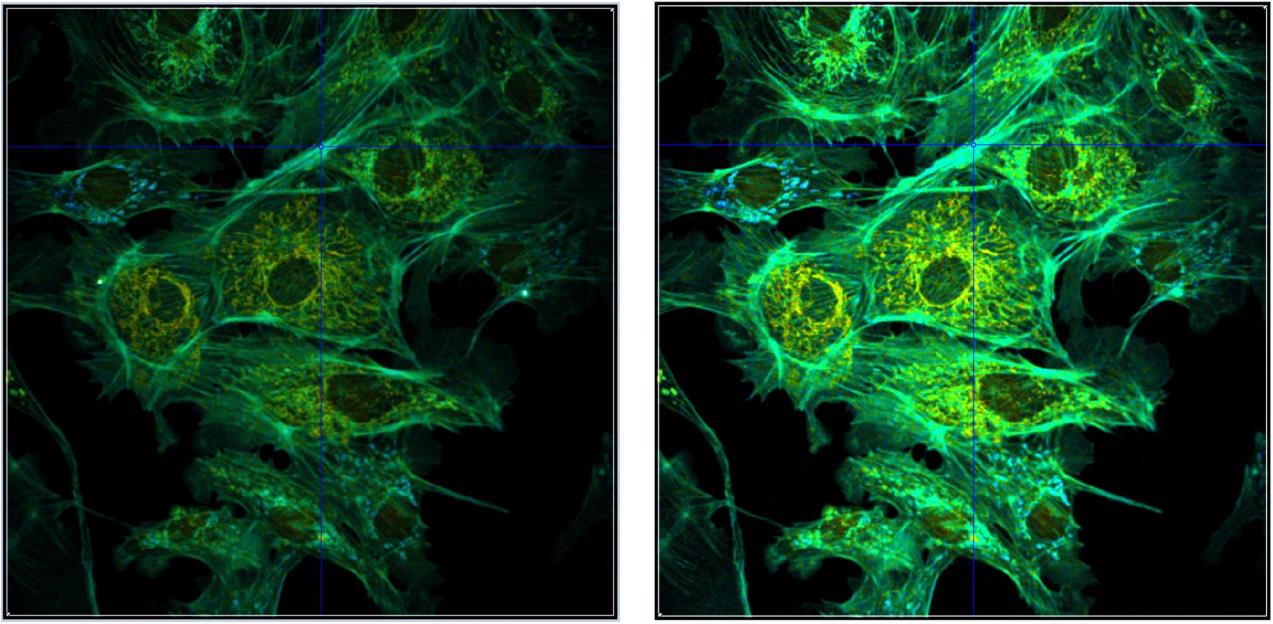
图39:包含一些非常亮点的图像。左:强度范围的自动缩放,自动缩放功能可将强度缩放到最亮的特征,获得的强度范围不适合图像的其余部分。右:手动缩放可在正确的强度范围内生成图像,单指数拟合的寿命,颜色范围从2000 ps(蓝色)到 3000 ps(红色)。
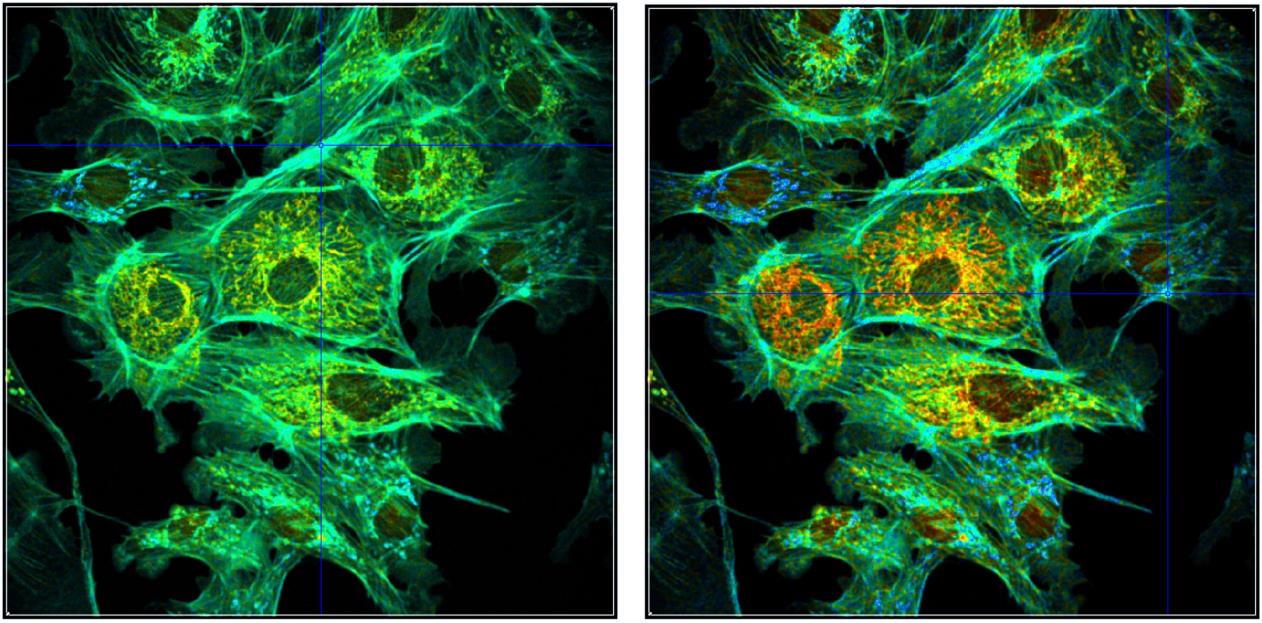
图40:图39所示数据的不同表示形式,单指数寿命,手动强度缩放。左:颜色方向 b-g-r,颜色范围为 2000 至 3000 ps。右:颜色方向 b-g-r,颜色范围为 2300 至 2700 ps。
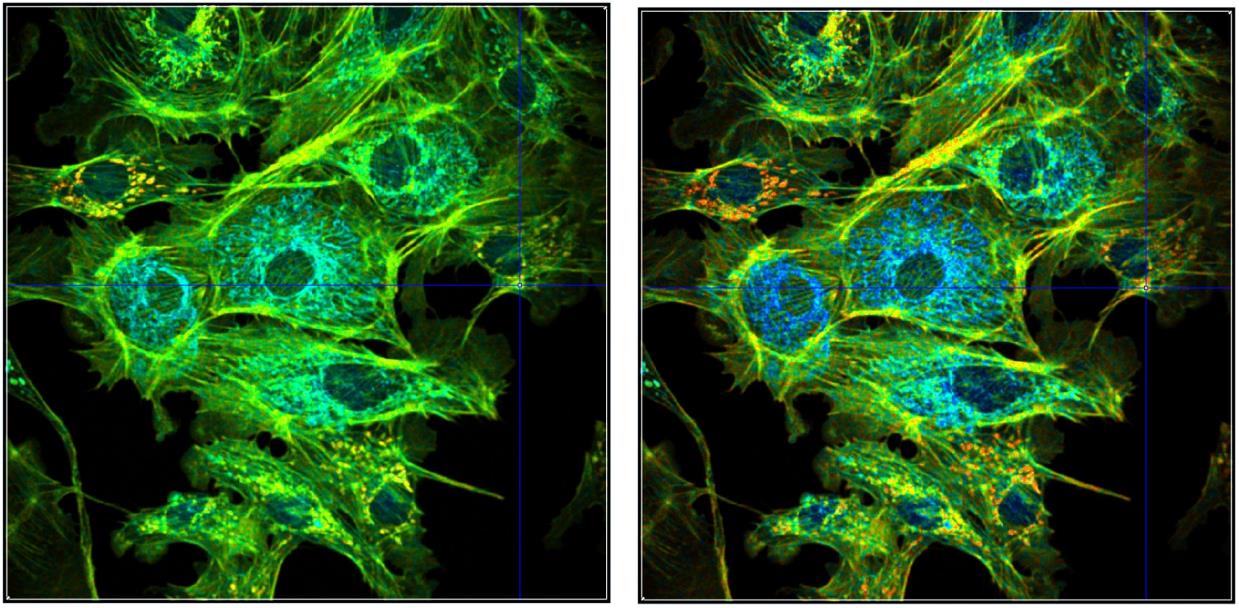
图 41:图 39 中所示数据的不同表示形式,单指数寿命,手动强度缩放。左:颜色方向 r-g-b,颜色范围为 2000 至 3000 ps。右:颜色方向 r-g-b,颜色范围为 2300 至 2700 ps。
总结
荧光寿命可以从TCSPC FLIM数据中得出,信噪比接近每像素光子数的平方根。因此,表征FLIM数据质量的最重要参数是光子数。通过使用实际示例,我们已经证明,通过简单地优化探测效率和采集时间,可以获得光子数为10倍。通过使用高效率的探测器,可以增加4倍,优化的像素合并策略可以增加25倍。总而言之,这是光子数为1000倍、信噪比为32倍的提升。我们并不是说在所有情况下都可以达到如此大的改进,但几乎在任何时候都可以实现相当大的改进。
FLIM系统的第二个重要参数是光子效率,光子效率描述了系统探测到的单个光子对结果的贡献程度。换句话说,它描述了系统与理想信噪比SQRT(N)的接近程度。虽然TCSPC系统接近理想,但光子效率通常可以通过使用正确的TCSPC定时参数,避免记录背景信号以及使用足够快IRF的探测器来优化。通常,光子效率提高两到四倍是可能的,只需遵守一些简单的信号记录规则即可。
当记录和分析多指数衰减函数时,数据质量变得尤为重要。在最常见的FLIM应用中,多指数衰减是必须的。然后,信息主要在于衰减分量的振幅和寿命,而不是净衰减函数的表观寿命。这意味着不仅探测效率和光子效率很重要,仪器响应函数IRF的宽度也很重要。此外,解析多指数衰减函数的选项在很大程度上取决于衰减函数的形状,它们偏离单指数曲线的距离越大,就越能很好地分辨它们。因此,考虑好FLIM选项的实验规划和样品优化设计可以对研究的结果产生巨大影响。
最后,数据分析在任何FLIM实验中都起着重要作用,正确应用的数据分析可以从记录的数据中提取最大数量的信息。此外,它能够以出版就绪的风格呈现数据,令人信服地支持相关出版物中提出的科学主张。
References
1. W. Becker, Advanced time-correlated single-photon counting techniques. Springer, Berlin, Heidelberg, New York,2005
2. W. Becker, The bh TCSPC handbook, 8th edition. Becker & Hickl GmbH (2019), available online on www.becker-hickl.com. Please contact bh for printed copies.
3. SPCImage NG data analysis software. In: W. Becker, The bh TCSPC handbook, 8th edition. Becker & Hickl GmbH(2019)
4. W. Becker (ed.), Advanced time-correlated single photon counting applications. Springer, Berlin, Heidelberg, New York (2015)
5. Becker & Hickl GmbH, DCS-120 Confocal and Multiphoton Scanning FLIM Systems, user handbook 87th ed. (2019). Available on www.becker-hickl.com
6. Becker & Hickl GmbH, Modular FLIM systems for Zeiss LSM 510 and LSM 710 family laser scanning microscopes. User handbook. Available on www.becker-hickl.com
7. Becker & Hickl GmbH, FLIM systems from Zeiss LSM 980 Laser scanning microscopes, addendum to modular FLIM systems for Zeiss LSM 510 and LSM 710 family laser scanning microscopes. Available on www.becker-hickl.com
8. Fast-Acquisition TCSPC FLIM: What are the Options? Application note, available from www.becker-hickl.com
9. W. Becker, V. Shcheslavkiy, S. Frere, I. Slutsky, Spatially Resolved Recording of Transient Fluorescence-Lifetime Effects by Line-Scanning TCSPC. Microsc. Res. Techn. 77, 216-224 (2014)
10. R.M. Ballew, J.N. Demas, An error analysis of the rapid lifetime determination method for the evaluation of single exponential decays, Anal. Chem. 61, 30 (1989)
11. W. Becker, B. Su, K. Weisshart, O. Holub, FLIM and FCS Detection in Laser-Scanning Microscopes: Increased Efficiency by GaAsP Hybrid Detectors. Micr. Res. Tech. 74, 804-811 (2011)
12. Wolfgang Becker, Cornelia Junghans, Axel Bergmann, Two-photon FLIM of mushroom spores reveals ultra-fast decay component. Application note, available on www.becker-hickl.com.
13. Becker & Hickl GmbH, Ultra-fast HPM detectors improve NADH FLIM. Application note, www.becker-hickl.com
14. Becker & Hickl GmbH, Two-Photon FLIM with a Femtosecond Fibre Laser. Application note, www.becker-hickl.com
15. Becker Wolfgang, Suarez-Ibarrola Rodrigo, Miernik Arkadiusz, Braun Lukas, Metabolic Imaging by Simultaneous FLIM of NAD(P)H and FAD. Current Directions in Biomedical Engineering 5(1), 1-3 (2019)
16. H.C. Gerritsen, M.A.H. Asselbergs, A.V. Agronskaia, W.G.J.H.M. van Sark, Fluorescence lifetime imaging in scanning microscopes: acquisition speed, photon economy and lifetime resolution, J. Microsc. 206, 218-224 (2002)
17. M. Köllner, J. Wolfrum, How many photons are necessary for fluorescence-lifetime measurements?, Phys. Chem. Lett. 200, 199-204 (1992)
18. I. Isenberg, R.D. Dyson, The analysis of fluorescence decay by a method of moments. Biophys. J. 9, 1337-1350 (1969)
